* Test
Septiembre
Octubre
Bloque II
* Test
Noviembre
Diciembre
Bloque III
Enero
>> TEST
>> BALANCEO DE ECUACIONES
INTRODUCCIÓN
Una ecuación química consta de:- Reactivos– sustancias iniciales, elementos o compuestos que se unen para formar una o varias sustancias nuevas.
- Productos – sustancias producidas o finales formadas durante la reacción.
¿Por qué balancear una ecuación química?
- Una ecuación química se balancea para que cumpla con la ley de conservación de la masa, que establece que la masa no se crea ni se destruye, por lo cual el número y tipo de átomo en ambos lados de la flecha en una ecuación deben ser iguales.
- Por lo tanto, si tenemos un cierto número de átomos de un elemento en el lado izquierdo de una ecuación, tenemos que tener el mismo número en el lado derecho.
BALANCEO DE ECUACIONES POR EL MÉTODO DE TANTEO
Este método consiste en escribir coeficientes estequimétricos al azar hasta igualar el número de átomos en ambos lados de la ecuación.
1. Escribir la ecuación con la estructura básica para la reacción.
H2(g) + Cl2(g) --> HCl(g)
2. Contar los átomos de los elementos de los reactivos y de los productos.
2 átomos de H + 2 átomos Cl --> 1 átomo de H y 1 átomo de Cl
3. Escribir coeficientes para que el número de átomos de cada elemento sea igual en ambos lados de la ecuación. Nota: Nunca se debe cambiar un subíndice de una fórmula química, solamente se puede agregar coeficientes estequiométricos.
H2(g) + Cl2(g) --> 2 HCl(g)
2 átomos de H + 2 átomos Cl --> 2 átomos de H y 2 átomos Cl
4. Los coeficientes deben ser los números enteros más pequeños posibles.
5. Asegurarse de que el número de átomos de cada elemento sea igual en ambos lados de la ecuación.
http://www.iesaguilarycano.com/dpto/fyq/ajuste.html
http://www.educaplus.org/play-69-Ajuste-de-reacciones.html
____________________________________________________________________________
Referencias
Rodríguez, M., García, R. , Hernández, L. y Ramírez, I. (2011). Química Ciencias 3. Desarrollo de una cultura química en contextos cotidianos. México. Editorial Pearson Educación.
Balanceo de ecuaciones químicas (2011). Recuperado el día 08 de febrero de 2013 en http://balanceoecuaciones.blogspot.mx/2011/09/metodos-para-balancear-ecuaciones.html
Febrero
>> TERCERA REVOLUCIÓN QUÍMICA: APORTACIONES DE LEWIS y PAULING.
______________________________________________________
VALENCIA
VALENCIA
Es una medida de la cantidad de enlaces quimicos formados por los átomos de un
elemento.
elemento.
Hay dos tipos de valencia:
a) Valencia positiva máxima: Es el número positivo que refleja la capacidad de
combinación de un átomo. Este número coincide con el número del Grupo
de la Tabla Periódica al cual pertenece un elemento. Por ejemplo: El cloro
(Cl) pertenece al grupo VII A, entonces su valencia positiva es 7.
b) Valencia negativa: refleja la capacidad que tiene un átomo de combinarse con
otro. Se determina restando a 8, los electrones de valencia del elemento.
Por ejemplo: para el cloro 8-7= 1, entonces su valencia negativa es -1.
En los enlaces quimicos, para los elementos del grupo I al IV, se toma la valencia positiva
y para los elementos del grupo V al VII, se toma la valencia negativa.
GRUPO
|
1
IA
|
2
IIA
|
13
IIIA
|
14
IVA
|
15
VA
|
16
VIA
|
17
VIIA
|
VALENCIA
|
1
|
2
|
3
|
4
|
3
|
2
|
1
|
ELEMENTO
QUIMICO
|
Litio
(Li)
|
Berilio
(Be)
|
Boro
(B)
|
Carbono
(C)
|
Nitrógeno
(N)
|
Oxígeno
(O)
|
Flúor
(F)
|
______________________________________________________
APORTACIONES PARA LA TERCERA REVOLUCIÓN DE LA QUÍMICA
- JOHN DALTON: Describió a los átomos como partículas indivisibles que tenían puntos de unión para formar los compuestos existentes en la naturaleza.
- JOSEPH JOHN THOMSON: Identificó que los átomos tenían electrones y pensó que su unión se debía a éstos.
- WALTER KOSSEL: Indicó que en el enlace iónico (entre metales y no metales) los átomos comparten electrones.
- GILBERT N. LEWIS: Señaló que en un enlace covalente (entre no metales) los átomos comparten un par de electrones.
- LINUS PAULING: Explicó que la electronegatividad es la capacidad de un átomo para atraer electrones mediante un enlace químico.
- KOSSEL Y LEWIS: Concluyeron que cada uno de los átomos que participan en la formación de un enlace químico tiende a adquirir una estructura estable equivalente a la estructura del gas noble más próximo en la tabla periódica.
CONCEPTOS IMPORTANTES
REGLA DEL OCTETO: Al formarse un enlace químico los átomos se transfieren, aceptan o comparten electrones de tal manera que cada átomo tiende a completar la capa más externa con 8 electrones, adquiriendo la estructura electrónica del gas noble más cercano en la tabla periódica.
ESTRUCTURA DE LEWIS: El símbolo del elemento esta rodeado de puntos que corresponden a los electrones de valencia (determinado por el grupo de la Tabla Periódica).
ENLACE IÓNICO: Un metal reacciona con un no metal. Un átmo pierde, cede o da electrones a otro átomo para que este adquiera una estructura estable. Én este caso se forman iones, los cuales pueden ser positivos o cationes (cuando pierden electrones) o negativos o aniones (cuando ganan electrones).
ENLACE COVALENTE: Participan átomos o elementos no metálicos. Al combinarse forman moleculas estables y comparten electrones (par electrónico de enlace). En algunos casos, los átomos pueden estar unidos por enlcaes múltiples.
________________________________________________________________________
Repasa tus conoceptos:
http://www.educaplay.com/es/recursoseducativos/780183/aportaciones_de_cientificos_a_la_tercer_revolucion_quimica_.htm
http://en.educaplay.com/en/learningresources/24000/enlaces_quimicos.htm
http://www.educaplay.com/es/recursoseducativos/780224/conceptos_quimicos.htm
______________________________________________________
ELECTRONEGATIVIDAD
Linus Carl Pauling desarrolló una escala de electronegatividad, asignándole el valor de 4 al flúor (F), el elemento más electronegativo y al francio (Fr) 0.7, el elemento menos electronegativo de la tabla periódica. En la tabla de electronegatividades no se señala valores para los gases nobles porque son los elementos más estables.
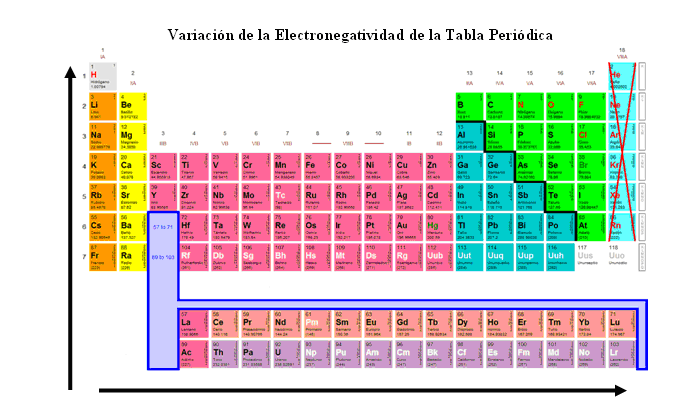
Con los valores de electronegatividad se puede determinar el tipo de enlace que forman los compuestos. Para ello se realiza lo siguiente:
1. Escribir la fórmula del compuesto.
2. Anotar el valor de electronegatividad de cada elemento del compuesto.
3. Restar el valor de menor electronegatividad al de mayor valor.
4. Cuando la diferencia es mayor de 0.5 indica que los electrones se transfieren y el enlace es iónico. Cuando la diferencia es menor o igual a 0.4 indica que los electrones se comparten y el enlcae es covalente.
Ejemplo:
Fórmula
|
Electronegatividad
|
Diferencia
|
Tipo de Enlace
|
F 2
|
4 4
|
4-4=0
|
Covalente
|
CO
|
2.5 3.5
|
3.5-2.5=1.0
|
Iónico
|
Li F
|
1.0 4
|
4-1.0=3.0
|
Iónico
|
Repasa tus conoceptos:
http://www.educaplay.com/es/recursoseducativos/618004/electronegatividad_2.htm
http://www.educaplay.com/es/recursoseducativos/617996/electronegatividad_1.htm
http://www.educaplay.com/es/recursoseducativos/780237/electronegatividad.htm
______________________________________________________
Referencias
Rodríguez, M., García, R. , Hernández, L. y Ramírez, I. (2011). Química Ciencias 3. Desarrollo de una cultura química en contextos cotidianos. México. Editorial Pearson Educación.
Valencia y número de oxidación (2010). Recuperada el 2 de febrero de 2013 en http://aprendeenlinea.udea.edu.co/lms/ocw/mod/resource/view.php?inpopup=true&id=140
Tipos de valencia. Recuperado el 2 de febrero de 2013 en https://sites.google.com/site/equipo4deciencias/ii-proyecto-1/2-indice/tipos-de-valencia
TEST 2016-2017 3° A, 3° C
Valencia y número de oxidación (2010). Recuperada el 2 de febrero de 2013 en http://aprendeenlinea.udea.edu.co/lms/ocw/mod/resource/view.php?inpopup=true&id=140
Tipos de valencia. Recuperado el 2 de febrero de 2013 en https://sites.google.com/site/equipo4deciencias/ii-proyecto-1/2-indice/tipos-de-valencia
TEST 2016-2017 3° A, 3° C
>> Conservadores alimenticios y catalizadores
____________________________________________________________
Las enzimas son proteinas que aceleran las reacciones químicas en los seres vivos. Las enzimas tienen una función muy importante en el deterioro de los alimentos. El deterioro enzimático en un alimento puede percibirse a través de cambios: color, olor, sabor. Este deterioro puede reducirse al bajar la temperatura, es decir al refrigerar los alimentos.
Cuando las frutas o legumbres son transportadas pueden ser golpeadas o rasgadas, eso facilita la entrada de microorganismos que causan importante deterioro alimenticio. Los microorganismos, además de causar la descomposición de los alimentos, también produce toxinas. Por tal motivo, al ingerir alimentos contaminados, se pude provocar intoxicación.
Otro factor que inluye en la descomposición de los alimentos es el oxígeno, que produce la oxidación de alimentos cuando están expuestos al aire. La oxidación se manifiesta mediante un sabor rancio u oscurecimiento en alimentos. Un alimento oxidado pierde sus propiedades nutritivas.
____________________________________________________________
La velocidad de reacción depende de la naturaleza de los reactivos, además de las condiciones en las que se da la reacción. Por ejemplo:
La velocidad de reacción depende de la naturaleza de los reactivos, además de las condiciones en las que se da la reacción. Por ejemplo:
a) Estado de agregación: La velocidad de reacción es directamente proporcional a las colisiones entre las moléculas de los recativos. Entre mayor movilidad, se favorecen las colisiones. En el estado líquido, las moléculas tienen mayor libertad de movimiento, lo que favorece la colisión entre recativos.
b) Tamaño de las partículas: Cuanto menor sea el tamaño de las partículas (pastilla pulverizada), se favorecerá las colisiones entre reactivos, y con ello, la velocidad de reacción.
c) Concetración de los reactivos: A mayor cantidad de moléculas en un espacio determinado (mayor cantidad de sustancia en una unidad de volumen), mayor es el número de colisiones.
d) Temperatura: Al aumentar la temperatura, las moléculas aumentan su velocidad de desplazamientolo, provocando que los choques entre los reactivos sean más frecuentes y la reacción más veloz.
e) Uso de catalizadores: Los catalizadores son sustancias que aumentan la velocidad de reacción. Estas sustancias se utilizan en pequeñas cantidades, participan en la reacción, pero no forman parte del producto. Las enzimas son catalizadores biológicos.
____________________________________________________________
Los conservadores ayudan a disminuir los riesgos de consumir alimentos contaminados o descompuestos. De esta manera, la industria produce alimentos con conservadores, los cuales pueden ser transportados a lugares lejanos, bajando los costos y aumentando su disponibilidad. Los conservadores pueden ser:
a) Inhibidores del crecimiento microbiano
b) Antioxidantes
Ejemplos de conservadores de alimentos
| |||
Conservador
|
Función
|
Uso
|
Riesgos
|
Nitritos y nitratos
|
Inhiben el crecimiento de Clostridium botulinum (microorganismo causante del botulismo)
|
Productos cárnicos: pescado, jamón, salchicha y demás embutidos.
|
Cáncer de colon y de esófago.
|
Ácido benzoico y benzoatos
|
Controla el crecimiento de levaduras, bacterias y hongos.
|
Jugos de frutas, bebidas carbonatadas, postres y alimentos fermentados.
|
Consumo excesivo puede ser dañino.
|
Ácido sórbico y sus sales.
|
Inhibe el crecimiento de microorganismos.
|
Bebidas, derivados cárnicos y lácteos, repostería.
|
Ninguno
|
Ácido acético y acetatos.
|
Inhibe el crecimiento de microorganismos.
|
Conservas de pescado, vegetales y encurtidos.
|
Ninguno
|
Sulfito (sales del ácido sulfuroso)
|
Inhibe el crecimiento de microorganismos.
|
Bebidas alcohólicas, frutas secas y jugos.
|
Son inocuos, aunque se han dado casos de hipersensibilidad en personas asmáticas y con acides gástrica.
|
Los conservadores no son peligrosos si se utilizan y consumen en cantidades permitidas, pero pueden serlo si se consumen en exceso.
"LA DOSIS HACE AL VENENO", (Paracelso)
____________________________________________________________Repasa tus conoceptos:
http://www.educaplay.com/es/recursoseducativos/784973/enzimas_alimenticias.htm
http://www.educaplay.com/es/recursoseducativos/784982/velocidad_de_reaccion.htm
http://www.educaplay.com/es/recursoseducativos/784992/conservadores.htm
http://www.educaplay.com/es/recursoseducativos/784996/conservadores1.htm
____________________________________________________________
Referencias
Rodríguez, M., García, R. , Hernández, L. y Ramírez, I. (2011). Química Ciencias 3. Desarrollo de una cultura química en contextos cotidianos. México. Editorial Pearson Educación.
>> TEST>> Medición de las reacciones químicas
El punto de referencia es la escala humana, es decir dimensiones que son similares a las del cuerpo humano; de tal manera que los cuerpos de magnitudes pequeñas corresponden a la escala microscópica y los objetos de enormes dimensiones corresponden a la escala astronómica.
Para representar estas cantidades, se utiliza la notación científica, la cual expresa cantidades mediante potencias de base diez, con exponentes negativos y positivos.
Para expresar cantidades más grandes que la unidad o múltiplos, se utilizan exponentes positivos. Por ejemplo: 1000 = 103 , 1000000 = 106. Cuanto mayor es el exponente positivo, mayor es la cantidad expresada.
Notación decimal
|
Notación exponencial
|
Prefijo
|
Símbolo
|
10
|
101
| ||
1 000
|
103
|
Kilo
|
K
|
1 000 000
|
106
|
Mega
|
M
|
1 000 000 000
|
109
|
Giga
|
G
|
1 000 000 000 000
|
1012
|
tera
|
T
|
Para expresar cantidades menores que la unidad o submúltiplos, se utilizan exponentes negativos. Por ejemplo:
Notación decimal
|
Notación exponencial
|
Prefijo
|
Símbolo
|
0.1
|
10-1
|
Deci
|
d
|
0.01
|
10-2
|
Centi
|
c
|
0.001
|
10-3
|
Mili
|
m
|
0.000001
|
10-6
|
Micro
|
µ
|
0.000000001
|
10-9
|
Nano
|
n
|
0.000000000001
|
10-12
|
Pico
|
p
|
El mol es la unidad utilizada en química para dterminar las cantidades de los componentes que intervienen en una reacción química.
El número de Avogadro (NA) es el número de átomos que contiene una muestra de 0.0120 kg de carbono 12; y equivale a 6.02 x 1023. Así, cualquier muestra que tenga una masa en gramos igual a la de su masa atómica equivale a un mol de átomos, es decir, 6.02 x 1023 átomos. Ejemplos:
El carbono tiene una masa atómica de 12 u.
Un mol de carbono = 12 g; contiene 6.02 x 1023 átomos de carbono.
El magnesio tiene una masa atómica de 24 u.
Un mol de magnesio = 24 g; contiene 6.02 x 1023 átomos de magnesio.
La molécula de agua H2O:
H2 = 2 átomos de hidrógeno = 2 (átomos) x 1 (masa atómica) = 2 u
O = 1 átomo de oxígeno = 16 u
Masa total = 2 + 16 = 18 u
Masa molar = 18 g por mol
1 mol de agua = 18 g (contiene 6.02 x 1023 “unidades fórmula del compuesto)
-------------------------------------------------------------------------------------------------------------------
Sal común Na Cl:
Na = 1 átomo de sodio = 23 (masa atómica) = 23 u
Cl = 1 átomo de cloro = 35.45 (masa atómica)= 35.45 u
Masa total = 23 + 35.45
Masa molar = 58.45 g por mol
1 mol del compuesto = 58.45 g (contiene 6.02 x 1023 “unidades fórmula” del compuesto)
Con base en lo anterior, se considera que el número de moléculas expresadas en una ecuación química equivalen al número de mol correspondiente, por ejemplo:
2H2 O2 2H2O
Dos moléculas de Una molécula de Dos moléculas de
hidrógeno equivalen + oxígeno equivale à agua equivalen
a Dos mol = 4 g a Un mol = 32 g a Dos mol = 36 g
Referencias
Rodríguez, M., García, R. , Hernández, L. y Ramírez, I. (2011). Química Ciencias 3. Desarrollo de una cultura química en contextos cotidianos. México. Editorial Pearson Educación.
Bloque IV
Marzo
>> TEST
>> ÁCIDOS Y BASES
Ácidos y Bases importantes en nuestra vida cotidiana
Roberto Boyle denominó a las sustancias como ácidos y bases. El término ácido proviene de de acidus que significa agrio y base o álcali, del vocablo árabe al-qaly significa cenizas. Las bases tienen un sabor amargo, son jabonosas al tacto y provocan quemaduras muy dolorosas cuando entran en contacto con la piel.
Boyle utilizó un colorante conocido como tornasol para clasificar los ácidos y bases. Determinó que los ácidos colorean de rojo el tornasol y las bases de azul.
Cuando un ácido reacciona con una base se produce una reacción de neutralización. El producto de sal reacción es sal más agua.
Nota: El tornasol es un indicador. Los indicadores son sustancias colorantes que al ser agregadas a los ácidos o a las bases en disolución, muestran cambios de color. Ejemplos de indicadores: extractos de vegetales, tornasol, fenolftaleína, azul de bromotimol y anaranjado de metilo.
Para conocer los niveles de acidez y basicidad, se utiliza la escala pH. Esta escala va del 0 al 14, y esta basada en la concentración de iones de hidrógeno (H+) en disolución. Una disolución que tenga un pH:
· Entre el 0 y el 2 es fuertemente ácida.
· Mayor que 2 y menor que 5, es moderadamente ácida.
· Mayor que 5 y menor que 7, es ligeramente ácida.
· Igual a 7, es neutra.
· Mayor que 7 hasta 9, es ligeramente básica.
· Mayor que 9 hasta 11, es moderadamente básica.
· Entre 12 y 14 es fuertemente básica.
Por ejemplo: Si jugo de manzana tiene un pH de 3.4, entonces se considera una sustancia moderadamente ácida.
Los ácidos y bases tienen diversas aplicaciones en la rama industrial, agrícola y doméstico. La química ha contribuido a mejorar la calidad de vida y al bienestar del ser humano ideando soluciónes en campos como la salud, la higiene y el diseño de nuevos materiales. En el caso de medicamentos, estos requieren un determinado pH ya que en un medio más ácido o más básico, reduce su efectividad porque no se produce una reacción. Respecto a la higiene, actualmente se fabrican jabones con determinados valores de pH para cada tipo de piel. Otro ejemplo relacionado con el pH es la acidez o alcalinidad (basicidad) del suelo, de ello depende la disponibilidad de nutrimentos para las plantas. Cuando los suelos son ácidos, se ve afectada la producción vegetal, disminuye la disponibilidad de algunos nutrientes, como el fósforo, calcio y magnesio, para el desarrollo normal de los cultivos el suelo debe tener un determinado nivel básico.
Como se puede ver, los químicos participan en el diseño de sustancias que resuelven diversas necesidades. Sin embargo, el uso indiscriminado de sustancias químicas y de los productos, pueden provocar daños a la salud y contribuir a la contaminación del ambiente. Ante estos problemas, las sociedades científicas han respondido a los nuevos retos y a las demandas sociales por un ambiente y economía sanos, tal es el caso de la American Chemical Society, cuyo código de conducta es: Los químicos tienen como responsabilidad profesional servir al interés público, al bienestar y al avance del conocimiento científico, preocuparse por la salud y el bienestar de sus compañeros, consumidores y la comunidad, comprender y anticiparse a las consecuencias medioambientales de su trabajo, evitar la contaminación y proteger el medio ambiente.
Modelo de ácidos y bases
Michael Faraday, físico inglés, descubrió que ciertas sustancias disueltas en agua conducen la corriente eléctrica, a eta sustancias las llamo electrolitos.
Con base en los descubrimientos acerca de la electricidad que realizó Faraday, el químico sueco Svante August Arrhenius, propuso una explicación acerca de los iones: cuando algunas sustancias como ácidos, bases y sales se disuelven en agua, se separan los iones y pueden ser atraídos por cargas contrarias produciendo corriente eléctrica.
La Disociación ocurre cuando en una disolución acuosa se separan los iones que se encuentran como tales en un compuesto iónico (unión de un metal con un no metal).
Se llama ionización cuando, en una disolución acuosa, se forman iones a partir de un compuesto con enlace covalente (unión de no metales).
El Modelo de Arrhenius explica
a) Los ácidos y bases en disoluciones acuosas. De acuerdo con Arrhenius, los ácidos son sustancias que se disocian en iones de hidrógeno al disolverse en agua. En estas disoluciones acuosas, un átomo de hidrógeno de cada molécula del ácido, deja un electrón y pasa a la disolución en forma de un ión hidrógeno que se representa como H+. Por ejemplo:
HCl (ac) à H+ (ac) + Cl-(ac)
HNO3 (ac) à H+ (ac) + NO3- (ac)
H2 SO4 (ac) à 2H+ (ac) + SO42- (ac)
b) Las bases son compuestos iónicos que al disolverse en agua forman iones hidroxilo (OH-). Una base esta compuesta por iones: un catión y uno o más iones hidroxilos. Cuando la base se disuelve en agua, los iones hidroxilo (OH-) se disocian o separan. Por ejemplo:
NaOH (ac) à Na+ (ac) + OH- (ac)
KOH (ac) à K+ (ac) + OH- (ac)
Al(OH)3 (s) à Al3+ (ac) + 3OH- (ac)
El modelo de Arrhenius fue el primer intento de explicar qué eran los ácidos y las bases a nivel microscópico. Sin embargo, con los avances de la Química, se comenzaron a realizar reacciones químicas en las que este modelo no se podía aplicar.
a) En reacciones ácido-bases que ocurren en ausencia de agua.
b) En sustancias que tienen grupos hidroxilo (OH) o hidrógeno (H) y no forman iones de agua.
c) En las sustancias que tienen propiedades tanto ácidas como básicas dependiendo de la sustancia con la que reaccionen.
¿Cómo controlar los efectos del consumo frecuente de los alimentos ácidos?
Para estar sanos, nutridos y poder realizar las actividades cotidianas los seres humanos consumimos alimentos. Estos en general incluyen nutrimentos que son sustancias químicas que proveen energía y elementos que forman nuevos componentes corporales o facilitan los procesos bilógicos del organismo.
Los nutrimentos son:
a) Carbohidratos: Aportan energía y constituyen parte estructural del organismo, por ejemplo forman parte del ADN.
b) Lípidos: Son fuente de energía y forman parte estructural, por ejemplo, constituyen la membrana celular.
c) Proteínas: Principales componentes estructurales del organismo, funcionan en la regulación de procesos y se utilizan escasamente como fuente energética en el organismo.
d) Vitaminas: Regulan los procesos fisiológicos, por ejemplo: la vitamina D es indispensable para la absorción del calcio y el fósforo.
e) Minerales: Tienen función estructural, por ejemplo: el calcio (Ca) y el fósforo (P) forman parte del tejido óseo.
Para una dieta correcta es importante consumir todos los nutrimentos a través de diversos grupos de alimentos de acuerdo al plato del bien comer, además de consumir agua y hacer ejercicio diariamente.
Cuando se abusa del consumo de alimentos ácidos se pude generar acidez estomacal o agruras lo cual lleva a una úlcera gástrica (lesión en las paredes del estómago). En condiciones normales, una capa de mucosa recubre las paredes del estómago y resiste las secreciones de ácido clorhídrico (HCl) y pepsina, pero en condiciones de acidez estomacal la resistencia de la capa mucosa se debilita y el ácido alcanza la pared muscular dele estómago lesionando los vasos sanguíneos.
· Pepsina: Enzima digestiva liberada por las células del estómago que degradan las proteínas de los alimentos.
Los antiácidos son compuestos químicos (bases) que los médicos recetan en caso de acidez estomacal ya que reaccionan con el ácido clorhídrico (HCl) del estómago para formar sal y agua (H2O).
ÁCIDO + BASE (ANTIÁCIDO) à SAL + AGUA
Los hidróxidos de aluminio y de magnesio son bases que en medio ácido liberan iones OH-. Por ejemplo, el hidróxido de aluminio Al (OH)3 reacciona con el ácido clorhídrico HCl de acuerdo con la siguiente reacción:
3HCl + Al (OH)3 à Al Cl3 + 3H2O
El hidróxido de aluminio es astringente, es decir, produce estreñimiento y el hidróxido de magnesio es laxante y para compensar sus efectos se encuentran juntos en algunos medicamentos.
El Bicarbonato de sodio NaHCO3 actúa como base al reaccionar con el ácido clorhídrico del estómago y libera dióxido de carbono CO2 de acuerdo con la siguiente reacción:
HCl + NaHCO3 à NaCl + CO2 + H2O
El CO2 irrita la mucosa gástrica y distiende las paredes del estómago, el gas se elimina por medio del eructo.
Referencias
Rodríguez, M., García, R. , Hernández, L. y Ramírez, I. (2011). Química Ciencias 3. Desarrollo de una cultura química en contextos cotidianos. México. Editorial Pearson Educación.